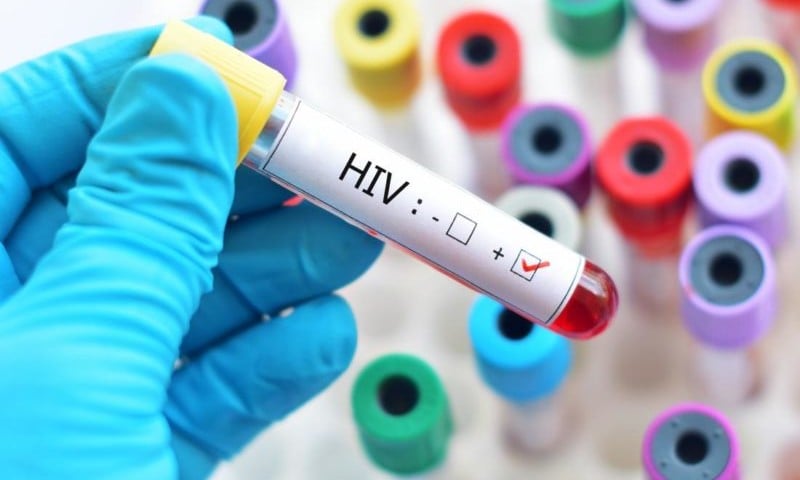
A Agência Nacional de Vigilância Sanitária aprovou nesta segunda-feira (12) o uso do lenacapavir injetável para a prevenção do HIV. O medicamento passa a integrar o conjunto de estratégias de profilaxia pré-exposição, a PrEP, como alternativa de longa duração às opções orais já disponíveis.
Aplicado apenas duas vezes por ano, o lenacapavir é indicado para adultos e adolescentes a partir de 12 anos, com peso mínimo de 35 quilos, que estejam em risco de infecção pelo HIV. Antes do início do uso, é obrigatório que a pessoa tenha resultado negativo para o vírus.
A aprovação acompanha recomendações da Organização Mundial da Saúde, que em julho de 2025 passou a indicar o lenacapavir como opção adicional de PrEP. Para a OMS, o medicamento representa a alternativa mais eficaz atualmente disponível após uma vacina contra o HIV.
Estudos publicados em 2024 reforçaram o potencial da droga. Uma pesquisa divulgada no New England Journal of Medicine apontou eficácia de 100% na prevenção do HIV entre mulheres participantes. Em outro estudo realizado no mesmo ano, com 3.265 pessoas de diferentes gêneros, apenas dois voluntários que utilizaram o medicamento foram infectados.
Dados apresentados durante a 25ª Conferência Internacional sobre Aids, realizada em Munique, mostraram que o lenacapavir foi tão eficaz que um dos ensaios clínicos chegou a ser interrompido antes do previsto. O acompanhamento envolveu mais de duas mil mulheres cisgênero em Uganda e na África do Sul e teve como foco o HIV-1, responsável pela maioria das infecções no mundo.
Diante dos resultados, o Unaids avaliou que o medicamento pode acelerar os esforços globais para acabar com a Aids como ameaça à saúde pública até 2030, meta prevista na Agenda de Desenvolvimento Sustentável da ONU. A entidade, no entanto, alertou para o desafio do acesso, já que o custo estimado do tratamento é de cerca de 40 mil dólares por pessoa ao ano.
Nos Estados Unidos, o lenacapavir foi aprovado em junho pela FDA. No Brasil, apesar da autorização para uso, a Gilead, fabricante do medicamento, informou anteriormente que o processo de submissão comercial no país ainda estava em fase de planejamento interno.
Com nome comercial Sunlenca, o lenacapavir surge como alternativa aos medicamentos orais de PrEP, disponíveis no SUS desde 2018 e utilizados de forma diária ou sob demanda antes da relação sexual. Atualmente, no Brasil, mulheres cisgênero não utilizam a PrEP sob demanda, devido a evidências científicas que apontam menor eficácia do método nas mucosas vaginais em comparação às anais.